Получение водорода из перекиси водорода: Производство перекиси водорода и надсернокислых соединений — Знаешь как
Производство перекиси водорода и надсернокислых соединений — Знаешь как
Производство перекиси водорода
Содержание статьи
 Перекись водорода представляет собой сильный окислитель, причем продуктами ее разложения являются только кислород и вода. Поэтому перекись водорода широко применяется в тех случаях, когда нежелательно загрязнение веществ, получаемых при окислении продуктами восстановления окислителя. Растворы перекиси водорода используют для беления дорогих тканей, мехов, масел, бумажной массы, в медицине и тонкой химической технологии. Высококонцентрированная перекись водорода используется для получения паро-газовой смеси в различных реактивных устройствах.
Перекись водорода представляет собой сильный окислитель, причем продуктами ее разложения являются только кислород и вода. Поэтому перекись водорода широко применяется в тех случаях, когда нежелательно загрязнение веществ, получаемых при окислении продуктами восстановления окислителя. Растворы перекиси водорода используют для беления дорогих тканей, мехов, масел, бумажной массы, в медицине и тонкой химической технологии. Высококонцентрированная перекись водорода используется для получения паро-газовой смеси в различных реактивных устройствах.
Надсернокислые соединения — персульфаты калия и аммония — являются промежуточными продуктами при производстве перекиси водорода и имеют самостоятельное значение как твердые окислители. Первый из них применяется также в качестве катализатора.
В настоящее время нашли промышленное применение способы получения перекиси водорода электролизом и через органические соединения: этилантрахинон, n -азотолуол и некоторые другие.
Получения перекиси водорода электролизом
Образование перекиси водорода в кислой среде возможно в результате как восстановительной, так и окислительной реакции:
O2 + 2Н++2e→ Н2O2
2Н2O — 2е → Н2O2 + 2Н+
Наличие двух электрохимических процессов образования перекиси водорода открывает принципиальную возможность непосредственного ее получения как на катоде, так и на аноде. Действительно, если ртутный или амальгамированный медный, или серебряный катод, погруженный в кислоту, омывать газообразным кислородом, то на нем образуется перекись водорода по реакции. Стандартный потенциал этой реакции φ°=+0,69 в.
Если бы электрохимическое восстановление на катоде ограничивалось только этой реакцией, то мы имели бы весьма экономичный и простой способ получения перекиси водорода.
Однако на катоде возможно дальнейшее восстановление перекиси водорода по реакции
H2O2 +2Н++2e → 2Н2O
со стандартным потенциалом φ°= + 1,77 в, а также непосредственное восстановление кислорода до воды:
О2 + 4Н+ + 4е → 2Н2O
Стандартный потенциал последней реакции φ°= +,23 в.
Как видно из сопоставления величин стандартных потенциалов, наиболее отрицательным потенциалом обладает реакция образования перекиси водорода. Следовательно реакция может протекать лишь в том случае, если перенапряжение реакции велико. Реакция тоже должна быть в максимальной степени заторможена, ибо в противном случае вся образующаяся перекись водорода будет успевать восстанавливаться до воды.
Увеличить скорость образования перекиси водорода можно, повысив концентрацию растворенного кислорода путем повышения давления кислорода в газовой фазе. Но вместе с повышением концентрации перекиси водорода скорость ее восстановления до воды возрастает и поэтому катодным восстановлением удается получать лишь разбавленные растворы перекиси водорода. Чтобы избежать высоких давлений и уменьшить потери образовавшейся перекиси водорода, Берль предложил применять полый угольный катод, обработанный гидрофобными веществами, например парафином. Наружная поверхность катода покрывается тонким слоем активированного угля, сильно адсорбирующего кислород. Через внутреннюю полость такого катода подается кислород или воздух. При катодной плотности тока 500 а/м2, напряжении от 2 до 3 в и 5° С можно получать 5% раствор Н202 с выходом по току ~66%.
Непосредственное получение значительных количеств перекиси водорода на аноде по реакции или в щелочной среде по реакции 2ОН— — 2е → Н2О2 не удается. Это происходит, по-видимому, потому, что на платиновом аноде идет интенсивное каталитическое разложение перекиси водорода.
Промышленное значение процесс анодного окисления получил только после того, как было установлено, что некоторые производные перекиси водорода, такие как надсерная кислота или персульфат аммония, значительно устойчивее в контакте с платиновым анодом, чем перекись водорода.
Существует три промышленных способа косвенного получения перекиси водорода, разработанных в Австрии и Германии. По способу Тейхнера (1905 г.) электролизом серной кислоты получают надсерную кислоту и затем ее разложением — перекись водорода. По способу Питча и Адольфа (1910 г.) электролизу подвергают кислый раствор бисульфата аммония и получают персульфат аммония. Затем его переводят в труднорастворимый персульфат калия, который отделяют от раствора. Перекись водорода получают разложением персульфата калия.
Риделю и Левенштейну в 1927—1930 гг. удалось преодолеть трудности непосредственного получения перекиси водорода из персульфата аммония и создать процесс по схеме — электролиз бисульфата аммония и разложение персульфата аммония на перекись водорода.
Электролитическое получение надсерной кислоты
 Надсерная кислота получается на гладком платиновом аноде при электролизе достаточно концентрированных растворов серной кислоты. Механизм анодного образования надсерной кислоты до настоящего времени является предметом обсуждения. Основными предложенными схемами являются следующие:
Надсерная кислота получается на гладком платиновом аноде при электролизе достаточно концентрированных растворов серной кислоты. Механизм анодного образования надсерной кислоты до настоящего времени является предметом обсуждения. Основными предложенными схемами являются следующие:
Непосредственный разряд ионов SO2-4 с образованием SO—4 ионов и дальнейшей их димеризацией.
Рис. 2. а — Относительное содержание:
H2SО4, HSO—4 и SO2-4 в серной кислоте
Образование надсерной кислоты как вторичный процесс окисления серной кислоты перекисью водорода, образовавшейся электрохимически на аноде (Глесстон и Хиклинг):
2Н2О — 2е → Н2О2 +2Н+ H2О2 + 2SО2-4 → S2О2-8+2ОH—
Вторичное образование надсерной кислоты за счет окисления серной кислоты атомарным кислородом, образующимся на аноде:
Н2О — 2е → 2Н++О
O + 2SO2-4 + H2О → S2О2-8+2ОH—
Механизм образования надсерной кислоты, предложенный Глесстоном и Хиклингом, следует признать маловероятным, так как в сильнокислых растворах, применяемых при электролизе и дающих наиболее высокие выходы надсерной кислоты, активность
воды резко понижена и разряд молекул воды в значительных количествах едва ли возможен. Кроме того, платиновые аноды, которые только и применяются в ванных, являются очень сильными катализаторами распада перекиси водорода.
Образование надсерной кислоты в условиях электролиза за счет атомарного кислорода, по-видимому, также не имеет места. Опытами А. Н. Фрумкина и сотрудников по электролизу раствора сульфата калия в воде, обогащенной тяжелым изотопом кислорода О18, было показано, что после электролиза образовавшийся персульфат калия не обогащается тяжелым изоразных концентраций; б — Зависимость активности воды и удельной электропроводности раствора H2SО4 от концентрации H2SО4.
Наоборот, если вести электролиз сульфата калия, обогащенного изотопом О18 в обычной воде, то в персульфате калия обнаруживается изотоп О18. Это свидетельствует о том, что на аноде вероятнее всего происходит реакция непосредственного разряда анионов серной кислоты. К таким же выводам пришли Н. А. Изгарышев, А. И. Бродский, Брайтер, Цу Юн-Цао с сотрудниками.
Эта диаграмма, полученная с помощью метода спектров комбинационного рассеяния света, показывает, что в разбавленных растворах серной кислоты, в основном, диссоциация происходит с образованием ионов SO2-4 . По мере повышения концентрации равновесие резко сдвигается в сторону ионов HSO—4. Так, уже при 2—2,5 моль/л серной кислоты концентрация SO2-4 оказывается ~5%, примерна столько же в растворе недиссоциированных молекул, а остальное приходится на HSO—4 Образование надсерной кислоты происходит только при высокой концентрации серной кислоты, когда концентрация SO2-4 становится уже очень малой. На рис. 2 область концентраций, наиболее благоприятных для получения надсерной кислоты, заштрихована. Следовательно, вероятно, что в образовании надсерной кислоты, при электролизе серной кислоты участвуют ионы HSO—4.
Равновесный потенциал реакции
2HSO—4 — 2e → 2H+ + S2O2-8
Вероятность протекания реакции образования персульфата тем больше, чем меньше положительное значение примет равновесный потенциал. Из уравнения (выше) видно, что это произойдет при максимальном увеличении концентраций HSO—4 т. е. в интервале концентраций серной кислоты 5—7 н. Этот интервал является оптимальным для получения надсерной кислоты, что подтверждает предположение об участии HSO—4 в электродном процессе.
На аноде наряду с образованием надсерной кислоты возможен разряд молекул воды, приводящий к выделению кислорода.
Судя по значению стандартных потенциалов, на аноде в первую очередь и исключительно должен идти процесс выделения кислорода. Для максимального подавления этого процесса следует вести электролиз из концентрированных растворов кислоты, в которых; максимально возможно снижена активность воды и повышена кислотность (рис. 2, б) и, следовательно, равновесный потенциал сдвинут в электроположительную сторону. Одним сдвигом равновесного потенциала не удается добиться преимущественного протекания реакции образования S2O2-8 . Необходимо еще выбрать материал анода, на котором перенапряжение выделения кислорода было бы возможно большим.
Таким материалом является гладкая платина. Выделение кислорода на гладкой платине в концентрированной серной кислоте сопровождается окислением поверхности платины — образованием поверхностных, и фазовых окислов, что видно из изменения анодного потенциала.
Состав окисных соединений платины, образующихся при разных потенциалах, различен. В области выделения кислорода на аноде образуются низшие окислы платины. При высоких потенциалах и концентрациях серной кислоты получаются окисные соединения иного характера, богатые кислородом и с большой энергией связи металл — кислород.
На электроде, покрытом такого рода окислами, перенапряжение выделения кислорода резко повышено, что благоприятствует протеканию реакции образования S2O2-8.
Предположение о разной природе поверхностных окислов подтверждается измерениями емкости двойного слоя на электродах, длительно работавших анодно при низких потенциалах и при высоких потенциалах в условиях получения надсерной кислоты. Действительно, кривые емкости 1 и 2 резко различны. На правой ветви кривой 1 имеется характерный пик десорбции, свидетельствующий о восстановлении адсорбированного кислорода. На кривой 2 такого пика практически нет, т. е. десорбция кислорода при этих потенциалах не происходит и, следовательно, прочность связи металл — кислород велика. Подъем в анодной области на кривой 2 начинается при потенциалах почти на 0,5 в более положительных, чем на кривой 1. Это непосредственно доказывает наличие торможений для реакции выделения кислорода на высших окислах платины.
Таким образом, условия, благоприятствующие получению надсерной кислоты, следующие: высокая концентрация серной кислоты, низкая температура и высокая плотность тока, материал анода с высоким перенапряжением выделения кислорода. На катоде надсерная кислота легко восстанавливается, поэтому необходимо отделять анодное пространство от катодного диафрагмой.
Исследования показали, что наивысшие выходы по току получаются при электролизе растворов серной кислоты с плотностью 1,3—1,45 г/см3 (содержащих соответственно 510—800 г/л H2SО4). Применение растворов с плотностью 1,3—1,35 г/см3 наиболее целесообразно, так как при дальнейшем увеличении концентрации (в указанных пределах) выходы по току остаются практически неизменными, а удельная электропроводность электролита падает (рис. 2).
Существенным фактором, влияющим на ход электролиза, является анодная плотность тока. Наивысшие выходы по току получаются при анодной плотности тока 5000—10000 а/м2, на практике чаще применяют—6000—7000 а/м2. Более высокие анодные плотности тока существенно не улучшают выход по току, но в то же время способствуют повышению напряжения на ванне. Что касается катодных плотностей тока, то желательно в пределах конструктивных возможностей работать с пониженными плотностями тока. Обычно катодная плотность тока находится в пределах 500— 600 а/м2. Материалом для анодов, при всех вариантах электролитического получения надсернокислых соединений, является платина. С целью экономии платины применяют тонкую фольгу (толщиной 0,05 мм) или проволоку, а также комбинированные аноды из тантала или титана (пассивного при анодной поляризации) с приваренными к нему листочками платины (комбинированные аноды позволяют применять более тонкие платиновые листочки).
Проводились исследовательские работы по замене платиновых анодов на аноды из электролитически осажденной РbO2, но достаточно надежных результатов не получено. В качестве материалов для катодов применяют свинец и графит. Свинец более удобен в конструктивном отношении, но на графите более низкое перенапряжение для водорода, что позволяет снизить напряжение на ванне на 0,3—0,4 в.
Получение перекиси водорода из надсерной кислоты и персульфата аммония
Электролит, вытекающий из ванн так называемый анолит,— подается в гидролизное отделение для выделения перекиси водорода.
Разложение надсерной кислоты и выделение из нее перекиси водорода осуществляется нагреванием раствора. При этом полезными являются как раз те реакции, которые приводили к наибольшим потерям тока и электролизных ваннах. При нагревании раствора надсерной кислоты идут реакции гидролиза.
Для уменьшения потерь необходимо с наибольшей возможной скоростью вести процесс и быстро удалять нары образовавшейся перекиси водорода. Применение вакуума позволяет вести гидролиз при более низкой температуре и уменьшить благодаря этому потери активного кислорода. Использование чистых растворов и соблюдение правильного режима гидролиза позволяет вести этот процесс с выходом 75—80% от теоретического. С увеличением концентрации H2S2О8 в растворе выход перекиси водорода возрастает.
Гидролиз протекает при остаточном давлении 110— 140 мм. рт. ст. Пары воды и перекиси водорода отделяются в сепараторе от раствора серной кислоты и конденсируются в виде 30% раствора Н2О2 в фарфоровых колоннах. Серная кислота частично, с целью очистки, подается в кварцевые дистилляционные аппараты. Остальная часть серной кислоты разбавляется водой до необходимой (исходной) концентрации и возвращается на электролиз.
Процесс осуществляют в свинцовом трубчатом гидролизере, имеющем форму змеевика, обогреваемого паром, либо в трубчатых аппаратах с трубками из стекла «пирекс», при больших масштабах производства используют аппараты типа «труба в трубе» . Поверхности аппарата, соприкасающиеся с рабочим раствором, покрыты кислотоупорной эмалью.
Гидролизер представляет собой вертикальный стальной сварной аппарат, состоящий из отдельных царг, снабженных паровыми рубашками. Внутрь аппарата вставляется стакан, который крепится к верхней крышке. Обогрев осуществляется паром давлением 6 ата, поступающим как в паровую рубашку, так и во внутренний стакан. Поверхность эмалирования 8,5 м2, высота 3085 мм. Электролит, содержащий надсерную кислоту, подают снизу. Пары перекиси водорода и воды вместе с серной кислотой отсасываются сверху.
Гидролиз растворов персульфата аммония ведут при 105— 115° С и остаточном давлении 50 мм рт. ст. Первая ступень гидролиза происходит в двух параллельно работающих гидролизерах; после разделения паровой и жидкой фаз раствор дополнительно проходит через гидролизер второй ступени.
Пары перекиси водорода и. воды конденсируют в конденсационных колоннах. Так как перекись водорода обладает меньшим давлением насыщенного пара, чем вода, то при частичной конденсации паров перекиси водорода и воды конденсат будет обогащен перекисью водорода, а паровая фаза — водой. Поэтому в первой конденсационной колонне удается получить наиболее концентрированный раствор Н2О2 (30—25% ). Паровая смесь, выходящая из первой колонны и содержащая еще значительные количества перекиси водорода, конденсируется во второй колонне, где получается более разбавленный раствор перекиси водорода. При необходимости включают третью колонну, в которой происходит улавливание последних остатков перекиси водорода и получаются ее разбавленные растворы,
Хранение перекиси водорода
Получаемая электролизом 30—35%-ная перекись водорода либо является конечным продуктом, либо поступает на дальнейшее концентрирование («укрепление»).
«Укрепление» перекиси водорода, т. е. превращение 30—35% раствора Н2О2 в продукт, содержащий 85—95% Н2О2, осуществляют перегонкой в специальных ректификационных аппаратах при 66—77° С и остаточном давлении 55 мм рт. ст. Устойчивость растворов перекиси водорода сильно уменьшается при наличии примесей. Следы платины, железа, меди, марганца, свинца (в виде ионов) и многих других веществ ускоряют процесс разложения. Совершенно чистая 90%-ная Н2О2 при 30°С теряет за год около 0,5% активного кислорода, т. е. является вполне стойким продуктом.
Устойчивость реальных растворов перекиси водорода значительно ниже, так как трудно достичь идеальных условий для обеспечения высшей чистоты продукта. Для обеспечения приемлемой стабильности перекиси водорода и получения высоких выходов при электролизе и гидролизе необходимо обеспечение определенных условий. Конструкционные материалы не должны сами каталитически ускорять процесс разложения перекиси и не должны загрязнять электролит веществами, способными вызывать каталитическое разложение. Исходные продукты, применяемые в процессе, должны быть тщательно очищены — вода и серная кислота—дистилляцией, соли — перекристаллизацией и т. д.
Несмотря на все принимаемые меры, перекись водорода, полученная в производственных условиях, разлагается с заметной скоростью. Чтобы повысить стойкость Н2О2, добавляют в растворы различные стабилизирующие вещества, например, 0,5 г/л Na4P2О7 • 10Н2О и 0,4 г/л салициловой кислоты. Для этой цели используют также фосфорную и бензойную кислоты, 8-оксихинолин и др.
Скорость разложения перекиси водорода возрастает с повышением температуры.
Растворы перекиси водорода хранят в алюминиевой таре. Алюминий— наилучший материал, практически инертный в отношении процесса разложения перекиси водорода и коррозионно-стойкий в растворах ее любой концентрации. Наличие в растворах перекиси водорода ничтожных количеств хлора вызывает интенсивную коррозию алюминия. Однако это явление можно полностью уничтожить введением в раствор ингибитора — нитрата аммония. Количество ингибитора, необходимого для подавления, коррозии, зависит от концентрации хлора в растворе. Сосуды для хранения растворов перекиси водорода должны иметь выход для выделяющегося при разложении кислорода.
С 85—95%-ной Н2О2 следует обращаться с большой осторожностью. Недопустимо соприкосновение ее с органическими веществами. Необходим тщательный надзор при ее хранении, так как возможно самопроизвольное разложение со взрывом.
Получение перекиси водорода через персульфат калия
Способ получения перекиси водорода через персульфат калия отличается от других способов тем, что из цикла электролиза выводится твердый продукт K2S2О8. При кристаллизации персульфата калия практически все примеси остаются в электролите. Твердый продукт оказывается весьма чистым и дальнейшее разложение его происходит с высоким выходом перекиси водорода. Электролит же для получения персульфата калия может содержать несколько большие количества примесей, чем в остальных двух способах.
Другой отличительной чертой способа является применение электролизеров без разделения анодного и катодного пространств диафрагмами. Необходимость применения таких ванн (одно растворные ванны) обусловлена тем, что электролит после выделения K2S2O8 содержит еще значительные концентрации S2O2-8 Если такой электролит направлять в катодные пространства диафрагменных ванн, то все ионы S2O8 будут восстановлены и произойдет значительная потеря перекисного кислорода. Если же оборотный электролит подавать в анодные ячейки, то тогда нужно организовывать специальную ветвь циркулирующего электролита, который проходит только через катодные пространства ванн. Оборачивание же электролита в простой схеме с бездиафрагменными ваннами затруднений не вызывает.
В бездиафрагменных ваннах для подавления процесса катодного восстановления персульфата аммония графитовые катоды, в виде круглых стержней, снабжаются защитной обмоткой — шнуром из кислотостойкого асбеста. Анод представляет собой алюминиевый гуммированный стержень с платиновыми штырьками, на которых натянут пучок платиновых проволок.
Для охлаждения ванна имеет стеклянные холодильники. Температура электролита 35—38° С. Объемная плотность тока 12—17 а/л. Напряжение на ванне 5,5—6,5 в, нагрузка 4500а. Корпус ванны керамический размерами 950x700x950 мм.
Электролизные ванны расположены каскадом и раствор в них последовательно поступает из одной в другую. Последовательно соединяются одиннадцать ванн, из которых одна резервная.
Электролит (оборотный) поступает в верхнюю ванну каскада. Он содержит 275—300 г/л (NH4)2SО4, 70—90 г/л H2SО4, 40 г/л K2SO4 и 75—80 г/л (NH4)2S2О8. В результате электролиза концентрация персульфата аммония повышается до 160—170 г/л. Средний выход по току составляет около 85%.Электролит, вытекающий из нижней ванны каскада, проходит через фильтр и охлаждается в вакуумном холодильнике. После охлаждения электролит поступает в бак, в котором проводят конверсию при температуре около 15° С. В этот реактор на каждый литр раствора вводят 100—110 г KHSO4. В результате обменной реакции образуется персульфат калия, который выпадает в осадок. Таким образом, удается вывести из цикла около 50% перекисного кислорода.
Персульфат калия отделяют на центрифуге, а раствор корректируют и, после добавления NH4SCN (0,1 мг/л) возвращают на электролиз. Гидролиз твердого K2S2O8 проводится периодически в специальном аппарате с добавлением серной кислоты. Образующийся при гидролизе бисульфат калия используют при конверсии персульфата аммония.
(~250 г/л) расход пара находится в пределах 28—29 кг/кг Н2О2. Наивысший расход пара, достигающий 40 кг/кг Н2О2, происходит при гидролизе растворов персульфата аммония (~230—240 г/л).
Способ получения перекиси водорода гидролизом К2S2О8 более сложен в аппаратурном оформлении. При организации производства перекиси водорода через H2S2O8 необходимо располагать достаточным количеством охлаждающей воды с температурой 7— 8° С, что может потребовать в летнее время наличия холодильной установки.
В способе с персульфатом калия можно допустить работу с несколько более загрязненным электролитом, так как при осаждении персульфата калия все примеси остаются в растворе, а в твердую фазу переходит чистый продукт. Таким образом, при гидролизе получается высокий выход, достигающий 91%. Несмотря на это, сложность аппаратурного оформления процесса и большое число операций в схеме делают метод получения перекиси водорода через персульфат калия малоперспективным.
Статья на тему Производство перекиси водорода
Получение водорода и кислорода — урок. Химия, 8–9 класс.
Получение кислорода
В лаборатории кислород получают разложением перманганата калия при нагревании или разложением пероксида водорода в присутствии катализатора:
2KMnO4=tK2MnO4+MnO2+O2↑.
2h3O2=MnO22h3O+O2↑.
Собирают кислород вытеснением воды или вытеснением воздуха.
Прибор для получения кислорода из перманганата калия
и собирания вытеснением воды
Прибор для получения кислорода
из пероксида водорода и собирания
вытеснением воздуха
Обнаружить выделившийся кислород можно с помощью тлеющей лучинки. В сосуде с кислородом лучинка разгорается ярким пламенем.
Получение водорода
В лаборатории водород получают действием соляной или разбавленной серной кислоты на металлы (цинк, железо, алюминий).
Zn+2HCl=ZnCl2+h3↑,
Zn+h3SO4=ZnSO4+h3↑.
Собирают водород вытеснением воды или воздуха. Сосуд для водорода при вытеснении воздуха располагают дном вверх.

Доказать наличие водорода в пробирке можно, если поднести её к пламени спиртовки. Водород взрывается, и раздаётся характерный хлопок.
Получение водорода — Знаешь как
 Рис. 56. Шарик натрия на поверхности воды
Рис. 56. Шарик натрия на поверхности воды
Атом водорода состоит из ядра и одного электрона. С атомами металлоидов атомы водорода образуют ковалентные связи, более или менее поляризованные. В некоторых из этих соединений (Н2O, НСl и др.) состояние атома водорода приближается к ионизированному Н+.
Главным источником получения водорода служит вода. Для получения из нее водорода можно воспользоваться способностью многих металлов вытеснять из воды водород с одновременным образованием гидроокисей или окисей взятых металлов. Особенно легко уже при обыкновенной температуре взаимодействуют с водой щелочные металлы натрий и калий, а также кальций, барий и др.
Если кусочек натрия бросить в чашку с водой, то происходит энергичная реакция; натрий с шипением начинает двигаться по поверхности воды, вытесняя из нее водород. При этом образуется так много тепла, что натрий плавится и превращается в шарик, который быстро уменьшается в размерах и вскоре исчезает (рис. 56). Иногда разогревание столь сильно, что выделяющийся водород загорается.
Взаимодействие натрия с водой выражается уравнением
2Na + 2Н2O = 2NaOH + Н2
Сущность этой реакции заключается в отдаче электрона атомом натрия одному иону водорода из молекулы воды. Атомы натрия превращаются при этом в положительно заряженные ионы, в виде которых и входят в состав NaOH, а ионы водорода превращаются в атомы, связывающиеся затем попарно с образованием молекул Н2. Аналогично протекает реакция с калием и кальцием.
Кроме указанных металлов, с водой могут взаимодействовать и другие металлы, но уже при более высоких температурах. Так, магний вытесняет водород из воды при температуре ее кипения, цинк и железо только при накаливании их в струе водяного пара. Во всех этих случаях водород, находящийся в состоянии, близком к ионизированному, получает электроны от атомов металла и превращается в нейтральные атомы.
В промышленности для получения водорода из воды пользуются следующими методами.
Конверсионный метод является наиболее распространенным методом получения водорода, особенно идущего на синтез аммиака. При работе по этому методу сквозь слой раскаленного угля пропускают водяной пар. Образующаяся при этом смесь окиси углерода с водородом носит название водяного
г а з а и может применяться как газообразное топливо . Если процесс ведется с целью получения водорода, то для удаления из полученной смеси окиси углерода водяной газ пропускают вместе с водяным паром над раскаленной окисью железа, служащей катализатором. Окись углерода взаимодействует с водяным паром, образуя водород и углекислый газ. Эта реакция, называемая конверсией окиси углерода, выражается уравнением
(Н2) + СО + Н2О ⇄ СО2 + Н2 + (Н2) + 10 ккал
При низких температурах равновесие сдвинуто вправо, а с повышением температуры смещается в сторону образования исходных веществ.
Так как реакция протекает с достаточной скоростью только при температурах не ниже 450°, то для повышения степени конверсии окиси углерода водяной пар добавляют к водяному газу в количестве, значительно большем, чем это следует из уравнения реакции, благодаря чему равновесие, несмотря на высокую температуру, остается сильно сдвинутым вправо.
Образовавшийся в результате конверсии углекислый газ отделяют от водорода, промывая газовую смесь водой, под давлением 20 ат. Для окончательной очистки водород пропускают еще через ряд растворов, поглощающих все примеси.
При работе по конверсионному методу вместо водяного газа часто пользуются другими газами, содержащими окись углерода, в частности генераторным газом.
Железо-паровой метод является наиболее старым из методов получения водорода, утратившим в настоящее время свое былое значение. Метод основан на взаимодействии железа с водяным паром при пропускании последнего над накаленными железными стружками:
3Fe + 4Н2О ⇄Fe3О4 + 4Н2 + 35,3 ккал
Реакция обратима и в направлении слева направо идет с выделением тепла. Следовательно, в соответствии с принципом Ле-Шателье, чем ниже температура, тем сильнее равновесие должно быть сдвинуто в сторону образования водорода. Однако при низких температурах из-за малой скорости реакции равновесие устанавливается слишком медленно. Поэтому на практике реакцию ведут при температурах не ниже 700°. При 700° равновесная смесь содержит приблизительно равные объемы водорода и водяного пара, т. е. половина пропускаемого пара остается неиспользованной. Так как образующийся водород вместе с избытком водяного пара сейчас же удаляется из сферы реакции, то процесс идет непрерывно до тех пор, пока все железо не превратится в окалину. Образовавшуюся окалину восстанавливают затем водяным газом и снова пускают в реакцию.
Электрохимический метод получения водорода
При наличии дешевой электрической — энергии экономически целесообразно получать водород из воды, разлагая ее электрическим током. Преимуществом этого метода является высокая степень чистоты получаемого водорода, что исключает необходимость в весьма сложных устройствах для его очистки от примесей. Кроме того, с электролизом воды в настоящее время связано и получение тяжелой воды, необходимой для ядерных реакторов.
Электрохимическим методом получают около 18% мировой продукции водорода.
Некоторое количество водорода получается также методом глубокого охлаждения коксового газа. При нагревании каменного угля без доступа воздуха до 900—1200° образуется так называемый коксовый газ — смесь, содержащая около 50—60% водорода; твердый остаток представляет собой кокс. Для выделения водорода из коксового газа последний подвергают глубокому охлаждению. При этом все газы, кроме водорода, переходят в жидкое состояние и таким путем отделяются от водорода.
За последние двадцать лет в качестве источника получения водорода стал широко применяться метан, содержащийся в природных газах и газах переработки нефти. В 1940 году в США из нового вида сырья было получено 5% водорода, идущего на синтез аммиака, в 1945 году — уже 45%, а в 1953 году—-66%.
Получение водорода из метана можно осуществить разными способами:
1) термическим разложением метана:
СН4 = С + 2Н2 + 18 ккал
2) взаимодействием метана с водяным паром:
СН4 + Н2О = СО + 3Н2 — 49 ккал
3) взаимодействием метана с двуокисью углерода или со смесью двуокиси углерода я водяного пара:
СН4 + СО2 = 2СО + 2Н2 —60,1 ккал
3СН4 + СО2 + 2Н2О = 4СО + 8Н2 — 158,6 ккал
4) неполным окислением метана:
2СН4 + О2 = 2СО + 4Н2 + 16,1 ккал
При всех этих способах, кроме первого, получаются газовые смеси с сравнительно высоким содержанием окиси углерода. Для увеличения выхода водорода эти смеси вместе с водяным паром подвергают конверсии.
Если водород не используют непосредственно на месте получения, то его транспортируют в сжатом состоянии в стальных баллонах, где он находится под большим давлением.
В лабораториях водород обычно получают действием разбавленной серной или соляной кислоты на цинк:
Zn + H2SО4 = ZnО4 + Н2
Вместо цинка можно взять железо, но в этом случае реакция идет гораздо медленнее.
Водород, получающийся при действии кислот на цинк и другие металлы, всегда содержит пары воды, а также некоторые газообразные примеси. Если нужен сухой водород, то получающийся газ освобождают от водяных паров, пропуская через концентрированную серную кислоту, жадно поглощающую влагу. Для удаления других примесей пользуются растворами различных солей.
65 66 67
Вы читаете, статья на тему Получение водорода
Получение водорода химическим способом в домашних условиях |

Самый первый элемент, который вы встретите, открыв периодическую таблицу Менделеева это водород. Весьма простое вещество водород (h3) представляет собой бесцветный газ. Водород, сам по себе, горючь и взрывоопасен. Водород нетоксичен, но практически не встречается в природе в чистой виде – его, как правило, извлекают из других веществ разнообразными способами. В этой статье описано простой и доступный рецепт получения водорода химическим способом.
Получение водорода в домашних условиях:
Получить водород в домашних условиях, на пример, для того что бы надуть воздушный шарик или просто из любопытства. Можно достаточно быстро и просто, с минимальными затратами времени и денег – вам для этого не нужны редкие химические реактивы.
Предупреждение:
Водород — бесцветный газ, который горюч и взрывоопасен – проводите свои опыты, соблюдая все правила техники безопасности!!!
Рецепт первый, не проверенный:
Вам понадобится поваренная соль, медный купорос и алюминиевая фольга или проволока (алюминиевая стружка), вода и стеклянные ёмкости для смешивани.
Насыпьте в отдельный одноразовый стаканчик медный купорос (количество выбирайте сами), а в другой стаканчик поваренную соль в таком же количестве (купорос и соль пропорция один к одному) После вам необходимо растворить в стеклянной банкевашу смесь. Далее вам необходимо высыпать в раствор соли и медного купороса алюминиевую стружку и можете наблюдать выделение водорода.
Рецепт второй, проверенный нами:
Я делал так: взял медный купорос и каустическую соду (средство для прочистки труб типа крот), по чайной ложке (пропорция 1:1) и растворил в ста миллилитрах воды. После чего высыпал туда мелко нарезанную алюминиевую проволоку. Смесь аж забурлила, очень активно начал выделятся водород, и выделялся до того момента пока смесь была голубого цвета. Когда смесь стала белой, водород уже не выделялся, хотя бурление продолжалось. Видимо медный купорос весь прореагировал и его необходимо туда добавлять снова и снова. Я поджигал смесь и она горела оранжевым пламенем пока была синей и выделялся водород, как побелела — гореть перестала. Если вы начинающий химик и не знаете всех правил техники безопасности, то поджигать смесь я вам не советую — это взрывоопасно!!!
P.S.: Я постарался наглядно показать и описать не хитрые советы. Надеюсь, что хоть что-то вам пригодятся. Но это далеко не всё что возможно выдумать, так что дерзайте, и штудируйте сайт https://bip-mip.com/
Водород, подготовка к ЕГЭ по химии
Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) — самый легкий химический элемент, при обычных условиях — газ
без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород — самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).

Степени окисления
Проявляет степени окисления: -1, 0, +1.
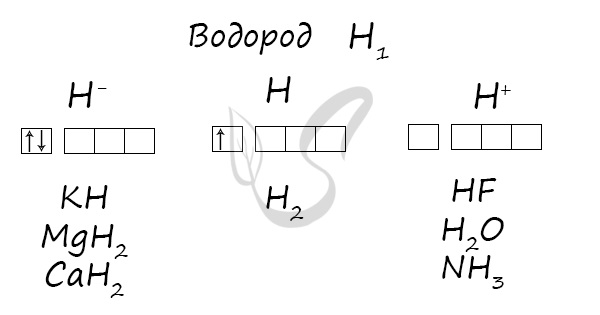
Получение
В промышленности водород получают различными методами:
- Конверсия с водяным паром при t = 1000 °C
- Методом газификации угля, торфа, сланца
- Электролизом водных растворов щелочей
- Каталитическим окислением кислородом (неполное окисление)
CH4 + H2O → CO + H2
C + H2O → CO + H2
H2O → H2↑ + O2↑
CH4 + O2 → CO + H2

Лабораторные методы традиционно отличаются от промышленных своей простотой. В лаборатории водород получают:
- Вытеснением водорода из кислот
- Гидролизом гидридов
- Взаимодействием активных металлов с водой
- Реакцией цинка или алюминия с раствором щелочи
Fe + HCl → FeCl2 + H2↑
CaH2 + H2O → Ca(OH)2 + H2↑
Ca + H2O → Ca(OH)2 + H2↑
Al + NaOH + H2O → Na[Al(OH)4] + H2↑
Химические свойства
- Как восстановитель реагирует с кислородом, галогенами, азотом, серой, оксидами металлов. При комнатной температуре из перечисленных
реакция идет только со фтором. - Как окислитель реагирует с металлами
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых
выше, чем у водорода:
H2 + O2 → (t) H2O
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)
H2 + N2 → NH3
H2 + S → H2S
H2 + ZnO → Zn + H2O

Na + H2 → NaH (гидрид натрия)
Mg + H2 → MgH2
Вода
Химические свойства:
- Реакция с металлами
- Реакции с основными и кислотными оксидами
- Гидролиз солей
- Реакция с гидридами активных металлов
- Реакции с C, CO, CH4
- С галогенами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
K + H2O → KOH + H2
Реагирует с основными оксидами — с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами —
с образованием соответствующих кислот. Не забывайте сохранять степени окисления!
CaO + H2O → Ca(OH)2
P2O5 + H2O → H3PO4
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3),
а другой — по аниону (Na2CO3).
Na2CO3 + CrBr3 + H2O → Cr(OH)3↓ + CO2 + NaBr
LiH + H2O → LiOH + H2↑
C + H2O → CO + H2
H2O + CO → (кат.) CO2 + H2
H2O + CH4 → (кат.) CO + H2
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты — без нагревания)
Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты — при нагревании)

Кристаллогидраты
Кристаллогидраты — кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в
состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O,
Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O.
Медный купорос имеет характерный голубой цвет, а безводный сульфат меди — белый.

В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует
вычесть кристаллизационную воду и найти массу безводного сульфата калия.

Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
K2O2 + H2O → KOH + H2O2
BaO2 + H2SO4 → BaSO4 + H2O2
В разбавленных растворах пероксид водорода легко разлагается:
H2O2 → H2O + H2↑
Также перекись проявляет окислительные свойства:
KCl + H2O2 + H2SO4 → Cl2 + K2SO4 + H2O

Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки,
предотвращая осложнение в виде бактериальной инфекции.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Опыты с перекисью водорода | Журнал Популярная Механика
Даже дети знают, что в жизни ничего не берется из ниоткуда. Тем не менее в нашем опыте небольшое количество жидкости на дне бутылки вдруг порождает красочную субстанцию в объеме, в несколько раз превышающем объем бутылки. За этим процессом стоит один из древнейших биохимических механизмов, имеющий большое значение для нашей жизнедеятельности.
Перекись водорода, а именно она лежит в основе нашего опыта, — очень неустойчивое соединение. Вещество, состоящее из двух атомов водорода и двух атомов кислорода, разлагается на кислород и воду даже при отсутствии каких-либо внешних стимулов. Однако процесс этот происходит очень медленно. Чтобы значительно ускорить его, достаточно добавить небольшое количество катализатора. Едва заметные следы присутствия меди, железа, марганца и даже ионов этих металлов способны запустить бурную реакцию разложения.
1. Налейте в пластиковую бутылку 200 мл 3%-ного раствора перекиси водорода. Такой раствор продают в аптеке в качестве антисептического средства. Вместо перекиси можно взять отбеливатель — их тоже готовят на основе h3O2.
Пероксид водорода (так иначе называют перекись) опасен для живых существ. Чтобы разложить h3O2 на кислород и воду, применяется фермент под названием «каталаза». Каталаза содержится почти во всех живых организмах, в том числе в дрожжах, которые мы используем в нашем опыте.
2. Добавьте пищевой краситель. Лучше использовать именно пищевые краски — не потому, что мы собираемся есть пену (это в любом случае не полезно), но потому, что в них точно не содержится катализаторов разложения перекиси водорода.
Перекись водорода — жидкость с плотностью 1,4 г/см3. Выделяющийся при ее разложении кислород — газ, один грамм которого занимает целых 700 см³.
3. Долейте моющее средство. Лучше всего подходят средства для мытья посуды. Объем — примерно половина от объема перекиси, то есть 100 мл.
Конечно, для опытов мы используем всего лишь 3%-ный раствор перекиси водорода, однако и этого достаточно, чтобы при ее разложении выделился газ в объеме гораздо больше исходного.
4. Разведите дрожжи в теплой воде, используя для этого отдельный стаканчик. Сделать это не так просто — дрожжи будут склеиваться комками. Нужно терпеливо размешать в 50 мл воды столовую ложку дрожжей, а затем дать им постоять пять минут. Решительно залейте дрожжевой раствор в бутылку с перекисью водорода и приготовьтесь наблюдать. Если повезет, реакция пойдет столь интенсивно, что пена буквально выпрыгнет из бутылки.
Чтобы увидеть выделившийся кислород, мы ловим его в мыльные пузыри. Для этого добавляем в раствор перекиси водорода пенящееся средство для мытья посуды.
На фото изображен, пожалуй, самый зрелищный, но вовсе не финальный момент эксперимента. Чтобы не залить странной субстанцией фотостудию, мы собрали ее в пластиковый мешок задолго до того, как из перекиси водорода перестал выделяться кислород. Достойным результатом может считаться выделение пены в количестве, способном заполнить как минимум три исходные бутылки.
Статья «Извержение пустоты» опубликована в журнале «Популярная механика»
(№7, Июль 2013).
Разложение пероксида водорода — Знаешь как
Каталитическое разложение пероксида водорода
 Разложение пероксида водорода это процесс разделения молекулы воды на воду и кислород, так как концентрированная перекись непрочное соединение, уже при комнатной температуре на свету разлагается по реакции:
Разложение пероксида водорода это процесс разделения молекулы воды на воду и кислород, так как концентрированная перекись непрочное соединение, уже при комнатной температуре на свету разлагается по реакции:
h3O2 = h3O + O
Реакция ускоряется со прикосновением с катализаторами ( MnO2 , PbO2 и другие ).
Пероксид водорода весьма удобный объект для иллюстрации каталитического процесса, влияния различных катализаторов на скорость химической реакции. Измерение объема кислорода, выделяющегося при разложении пероксида водорода, позволяет проводить этот опыт количественно, притом с достаточной степенью точности.
Лабораторное разложение перекиси
 Поэтому каталитическое разложение пероксида водорода удобный объект для научных исследований в области химической кинетики. То, что было осуществлено в науке химии как нечто новое, может быть повторено на внеурочных и факультативных занятиях как интересные ученические исследования.
Поэтому каталитическое разложение пероксида водорода удобный объект для научных исследований в области химической кинетики. То, что было осуществлено в науке химии как нечто новое, может быть повторено на внеурочных и факультативных занятиях как интересные ученические исследования.
Во время проведения демонстрационных экспериментов следует знать о пероксиде водорода (обычно 3%-ном) как о веществе, которое подвергается бурному разложению под действием различных катализаторов.
Pис. 2 Установка для количественного опыта разложения пероксида водорода:
1-колба для перегонки, 2 — пробирка с катализатором. 3 — чаша кристаллизационная, 4 — эвдиометр.
С этой целью в демонстрационные пробирки приливают по 30 мл раствора пероксида водорода и в каждый вносят одно из следующих веществ: оксид марганца (IV), оксид железа (III), активированный уголь, раствор перманганата калия, раствор хлорида железа (III), раствор дихромата калия, кусочек сырого мяса, содержащий фермент каталазу, находящуюся обычно в крови млекопитающих и человека.
Наблюдают за выделением пузырьков газа. Выделение кислорода подтверждают тлеющей лучинкой. Демонстрационные пробирки размещают в штативе с подсветом.
Количественный опыт каталитического разложения пероксида водорода может быть осуществлен в установке, показанной на рисунке 2. Для собирания газа можно использовать промышленный эвдиометр, имеющий градуировку. Различную скорость образования кислорода можно наблюдать в приборе, описание которого дано В. С. Полосиным, с использованием двух медицинских шприцев, а также с помощью установки для проецирования опытов на экран.
Активность катализатора
 Для сравнение можно взять пероксид водорода с одинаковой массовой долей Н2О2 (например, 3%) и два катализатора, например, раствор, содержащий комплексный ион [Сu(NН3)4]2+ и каталазу крови. Полуколичественные опыты для определения активности различных катализаторов разработал Г. П. Хомченко.
Для сравнение можно взять пероксид водорода с одинаковой массовой долей Н2О2 (например, 3%) и два катализатора, например, раствор, содержащий комплексный ион [Сu(NН3)4]2+ и каталазу крови. Полуколичественные опыты для определения активности различных катализаторов разработал Г. П. Хомченко.
Рис. 3. Определение активности различных катализаторов:
1 — пробирка с пероксидом водорода, 2 — колба с катализатором, 3 — стеклянная трубка с пробкой, 4 — Г образная газоотводная трубка, 5 — колба с водой, 6 — сифон, 7 — стакан с водой, 8 — зажимы.
Автор рекомендует проводить опыты в следующей последовательности:
1. Проверяют герметичность прибора (рис. 3), для чего закрывают пробки и открывают зажимы 8: вода не должна вытекать в стакан.
2. В пробирку 1 наливают 5 мл пероксида водорода (30%-ного) и перекрывают резиновую трубку зажимом 8.
3. В колбу 2 вносят катализатор и вставляют в нее трубку 3, соединенную с пробиркой 1.
4. Выравнивают давление внутри прибора с атмосферным давлением. С этой целью открывают зажим 8 сифона 6 и поднимают стакан 7 с водой так, чтобы вода в нем и в колбе находилась на одинаковом уровне, и затем снова закрывают зажим.
5. Воду выливают из стакана и наливают в него точный ее объем — 100 мл, предварительно отмерив его мензуркой.
6. Опускают кончик сифона 6 в стакан 7 с водой.
7. Открывают оба зажима 8 на приборе и быстро вливают пероксид водорода в колбу 2 с катализатором.
8. Через 3 мин вновь приводят давление внутри прибора к атмосферному давлению.
9. Закрывают зажим сифона 6 и измеряют объем воды, вытесненной в стакан кислородом.
10. Из измеренного объема воды вычитают 100 мл, т. е. объем воды, ранее добавленной в стакан.
По количеству выделившегося кислорода располагают испытанные катализаторы в порядке возрастания их каталитической активности.
Физические свойства пероксида водорода Н2О2
Сильный окислитель. Мол. массе 34,01; коэф. рефр. 1,4067 при 25 °С; плотн. 1448 кг/м3; т. кил 69,7 °С при 3,72 кПа и 80,2 °С при 6,25 кПа. Смешивается в любых соотношениях с водой. При воздействии 65% -ного р-ра Н2О2 на бумагу, опилки и другие горючие вещества происходит их воспламенение.
Концентрированный раствор может взрываться. Для раствора пероксида водорода низкой концентрации возможно саморазложение при воздействии тепла, в присутствии органической пыли или веществ, действующих каталитически (металлы, соли металлов). Хранить растворы пероксида водорода в темном прохладном месте. В присутствии Н2О2 средства тушения обильные струи воды.
Статья на тему Разложение пероксида водорода
Перекись водорода: практичная, экологически чистая, антибактериальная
Мне действительно смешно, что существует так много различных способов использования перекиси водорода. Это немного похоже на старую пародию Saturday Night Live о (выдуманном) продукте Shimmer : «New Shimmer — воск для пола», «Нет! Это десертная начинка ». Шутка, конечно, в том, что воск для пола и десертная начинка кажутся невозможными в одном продукте. (Подробнее о классическом ските SNL Shimmer …..)
Вот несколько способов использования h3O2:
- Как
полоскание и полоскание рта - Расслабляющее
ванны иножные ванны
- Для дезинфекции зубных щеток и
зубные протезы - Для стирки продуктов, чтобы фрукты и овощи дольше оставались свежими
- Для дезинфекции и дезодорации компостных ведер, разделочных досок, губок и щеток.
- Для стирки ковров, полов и окон.
- Удаление деревянной мебели и чистка деревянных настилов
- Удаление плесени
- Для осветления белья и удаления пятен
- Для очистки аквариумов
- Для поддержания чистоты воды при рыбоводстве
- В садоводстве: в качестве удобрения и спрея для растений.
- Для очистки бассейнов и спа, как альтернатива хлору.
- Таксидермисты используют его для очистки и отбеливания костей….,
- Используется для изготовления сыра
- Асептическая упаковка (те странные маленькие коробочки, в которых идет еда) опрыскивается ею
- Используется в продуктах для отбеливания зубов, лечения акне и
чистка контактных линз
- Да, и еще он отлично подходит для
очистка порезов и кожных инфекций! Знаете, как коричневые бутылки в аптеке …
Вот это вроде замечательно, правда . Здесь очень удобно иметь h3O2.
Вы находите все это забавным и интригующим, как и я? Вам интересно узнать больше?
Но это еще не все — перекись водорода также обладает прекрасным качеством: полезна для окружающей среды . Это преимущество имеет большое значение. Он хорош для рек, хорош для растений, и его можно использовать для замены хлорного отбеливателя, аммиака и других химикатов, которые вредны для рек и растений.
Хлор в бассейнах неприятен и многих раздражает
люди.Для кого-то это мелкая неприятность, для кого-то настоящая
опасность. Вместо этого можно использовать перекись водорода, она не токсична.
Точно так же можно использовать хлорные бытовые чистящие средства.
огорчает дом кошек и собак — для них он пахнет мочой, а также нездоров, когда они слизывают его со своей кожи и шерсти.
Все начинает сливаться вместе: h3O2 полезен для людей, животных, растений, рек …… и он распадается на воды и кислорода — что может быть нетоксичнее?
Если пойти еще дальше, h3O2 является частью цикла очистки земли .Он образуется при прохождении воды (h3O) через озоновый слой (O3), где
он захватывает другой атом кислорода (O), превращаясь в h302 (перекись водорода).
Итак, немного дождя доходит до нас. Когда поливаешь растения
с садовым шлангом перекись водорода отсутствует в воде и .
Добавление небольшого количества перекиси водорода в воду для растений отлично подходит для
сад (комнатные тоже). Сток не нанесет вреда ручьям и рыбной ловле.
так, как это делают многие садовые удобрения. Я скажу больше обо всем
который.
h3O2 также вырабатывается иммунной системой человека для борьбы с инфекциями. Белые кровяные тельца делают это ……
Эта история уже становится интересной? И запускается
тоже звучит немного повторяюще — как одна большая история применительно ко многим
разные вещи, в большом круге от людей до растений, от воды до рыбы
в небо?
История дезинфекции и нетоксичной очистки и природы —
вращение по кругу с разными словами, в зависимости от темы
мы обращаемся к ……
Что привело вас сюда сегодня?
Вы можете быть здесь, потому что уже знаете лотов о полезности
перекись водорода, а ты «фанат»! Добро пожаловать! Я надеюсь ты найдешь
новых использования, некоторая новая информация и немного пищи для размышлений здесь.
ИЛИ: это
тема может быть для вас совершенно новой. Может быть, вы ищете информацию о
одно конкретное использование — скажем, удаление пятен — но вы понятия не имели, что
перекись водорода находит широкое применение. Ну, может ты станет
любитель перекиси, а может и нет. В любом случае, я надеюсь, что вы найдете информацию, которую вы
пришли искать …. и, может быть, еще узнаем, что перекись очаровательна
достаточно, чтобы некоторые люди действительно копались в этом как в интересе. (Кто знал?)
Использование перекиси водорода
Этот сайт называется «Использование перекиси водорода», потому что я думаю, что ИСПОЛЬЗОВАНИЕ перекиси является наиболее, ну, полезным!
Это важно — на практике, а не в теории. может использовать перекись там, где есть преимущества. Практический
приложений, где мы действительно можем копаться и пробовать что-то, а также применять
идеи в реальной жизни. И мы все можем попробовать использовать h3O2 в
некоторые пределы безопасности! Хотите попробовать перекись водорода? какой
можете найти новые приложения, чтобы попробовать?
И: Если вы уже много лет используете перекись, надеюсь, вы также рассмотрите возможность поделиться своим опытом с другими здесь.
Истории и многое другое
Есть много интересных историй о перекиси.
- Хорошо, а как насчет «птичьего человека из Алькатраса», который, как говорят, использовал его для лечения птиц?
- Правда ли, что в некоторых известных целебных источниках уровень перекиси в воде выше обычного?
- Некоторые люди говорят, что он имеет другие преимущества для здоровья людей, и
даже для сельскохозяйственных животных … это правда? Что об этом говорит FDA?
И с этим согласен Министерство здравоохранения Канады? - Знаете ли вы, что он использовался во время Второй мировой войны для заправки катапульты и ракет?
Я тоже постараюсь разобраться в этих историях.
Наконец, есть много оснований, чтобы охватить около обработки, хранения, концентрации, «сортов» и смешивания. Вы бы хотели знать:
- Преимущества покупки 35% h3O2 и опасности
- Какие ограничения на доставку 35% и почему
- Разница между пищевой, технической и тем, что в коричневых бутылках в аптеке
- Как записаться
смешайте 35% перекиси до 3% или 6% …
- Как смешать 35% перекись в геле, чтобы получить гель, содержащий 3% (отлично подходит для порезов и кожных инфекций)
- Сколько использовать в
полив растений, чистка ковров или уход за бассейном
Дело в том…..
….. поиск способов ИСПОЛЬЗОВАНИЯ перекиси, которые приносят пользу нам самим, нашим домам, нашим семьям и другим людям … и приносят пользу животным и нашему миру.
Для чего бы мы ни использовали перекись водорода, давайте будем веселыми,
творческий и радостный — в этом духе нетоксичной жизни, полной роста и
здоровье воды, животных, растений и уборка дома… ..
Примечание. Перекись водорода также называется h302 — это ее химическое название — оба термина могут использоваться как синонимы.
Прошу прощения, если тема, которую вы ищете, не
здесь еще нет. Пожалуйста, вернитесь и посетите еще раз ….
Подписаться на информационный бюллетень исследователей перекиси водорода
Наш информационный бюллетень будет держать вас в курсе новых добавленных страниц, а также о некоторых приключениях, которые вы можете попробовать дома:
Не беспокойтесь! Ваша электронная почта будет использоваться ТОЛЬКО для отправки вам информационных бюллетеней.
,
22 Перекись водорода, которую вы можете попробовать сегодня
На протяжении как минимум века перекись водорода широко использовалась в качестве суперочищающего средства всеми, от домохозяек до хирургов-ортопедов. Но какие способы применения все еще поддерживаются надежной наукой сегодня, а какие следует считать устаревшими или даже опасными?
Спойлер: перекись водорода больше не рекомендуется для лечения ран или ухода за кожей, потому что врачи обнаружили, что она может привести к опасным осложнениям и замедлить заживление, но есть еще много способов, которыми она может быть полезна и полезна для вас.
Перекись водорода может показаться старомодной в своей безвкусной коричневой бутылке, но это определенно не натуральное домашнее средство. Это бытовая химия.
Правда, он отличается от воды только добавлением одной дополнительной молекулы кислорода. Но эта дополнительная молекула превращает его в мощный окислитель. Это причина того, что перекись водорода является таким универсальным очищающим средством, а также причиной, по которой ее нужно осторожно использовать для лечения людей и домашних животных.
Перекись водорода разлагается быстро и легко при контакте с воздухом или водой, поэтому считается более безопасной, чем хлорные химикаты.
По данным Центров по контролю за заболеваниями (CDC), перекись водорода убивает дрожжи, грибки, бактерии, вирусы и споры плесени.
CDC перечисляет конкретные концентрации, которые вам нужны, и сколько времени вам нужно, чтобы они оставались, чтобы убить различные организмы.
Вот как можно безопасно очистить свое тело и дом с помощью этого распространенного химического вещества.
1. Очистите посудомоечную машину
Чтобы удалить плесень и плесень в посудомоечной машине, опрыскайте сложные детали посудомоечной машины, где влага может задерживаться надолго после завершения цикла — в складках резиновых уплотнителей, ловушках и щелях посуды. корзина.
Исследование бытовых посудомоечных машин в 2016 году показало, что 83 процента протестированных посудомоечных машин оказались положительными на грибок, а 47 процентов протестированных посудомоечных машин содержали черные дрожжи E. dermatitidis , которые могут быть вредными для человека. E. dermatitidis был обнаружен в основном на резиновых прокладках посудомоечных машин.
Или, если вы хотите провести день в спа-салоне с этим трудолюбивым прибором, используйте перекись водорода, пищевую соду и эфирные масла, чтобы сделать ароматизированную бомбу для посудомоечной машины.”
2. Почистите раковину
Многие блоги по уходу за домом рекомендуют этот прием для очистки кухонной раковины: намочите поверхность раковины, а затем протрите ее пищевой содой, посыпанной губкой. После того, как вы протерете всю поверхность, налейте 3-процентную перекись водорода на поверхность и дайте ей отстояться, прежде чем промыть.
3. Дезинфицируйте столешницы и разделочные доски
По данным государственного университета Огайо, очистка счетчиков неразбавленной перекисью водорода эффективна при уничтожении E.coli и Salmonella на твердых поверхностях, таких как прилавки, когда им позволяют сидеть на поверхности в течение 10 минут при комнатной температуре.
На сайте известного реставратора Боба Вилы рекомендуется 10-минутное замачивание в 3-процентной перекиси водорода, чтобы убить микробы на деревянных разделочных досках.
4. Вымойте овощи — и продлите срок их хранения
Садоводы, выращивающие экологически чистые продукты, рекомендуют использовать 1/4 стакана 3-процентной перекиси водорода на галлон воды, чтобы помочь удалить бактерии с овощей.Если вы моете овощи с нежной кожицей, например салат, просто замочите их на 20 минут, а затем промойте.
Морковь, картофель и другие овощи с жесткой кожурой можно замачивать за 30 минут до ополаскивания и сушки. Поскольку бактерии могут вызвать потемнение овощей и фруктов, считается, что ванна с перекисью водорода дольше сохраняет их свежесть в холодильнике.
5. Очистите посуду
Если ваши противни, кастрюли и сковороды имеют запеченный слой коричневого цвета, Джилл Нистул из блога One Good Thing рекомендует сбрызнуть их пищевой содой, а затем сбрызнуть соду 3-процентной перекисью водорода. восстановлю их.Дайте им впитаться от 1 до 3 часов, прежде чем стирать грязь.
6. Избавьтесь от микробов в мусорных баках
После мытья мусорного ведра водой с мылом опрыскайте весь контейнер раствором перекиси водорода и водой в соотношении 1: 1. Дайте мусору высохнуть на солнце в течение нескольких часов. Так же, как перекись очищает поверхности, она помогает удалить микробы из мусорного ведра.
7. Глубокая чистка унитаза
Согласно CDC, перекись водорода эффективно удаляет микроорганизмы, включая бактерии, дрожжи, грибки, вирусы и споры, что делает ее хорошим выбором для очистки вашей ванной комнаты.
Чтобы очистить унитаз, добавьте в унитаз 1/2 стакана 3-процентной перекиси водорода, чтобы убить микробы и осветлить поверхность унитаза. Чтобы получить максимальную пользу, оставьте его в миске на 20 минут.
8. Сияние зеркал и стеклянных поверхностей
Распылите раствор воды и перекиси водорода в соотношении 1: 1 на стеклянные поверхности, затем протрите бумажными полотенцами, тканью без ворса или газетами, чтобы очистить поверхность без разводов.
9. Устранение плесени и грибка
Плесень и грибок могут быстро образоваться во влажной среде душевой кабины.
Чтобы убить их, не вдыхая токсичные пары отбеливателя, опрыскайте неразбавленной 3-процентной перекисью водорода и оставьте на 30 минут. Полоскание. Перекись убьет плесень и грибок, но вам все равно придется удалить оставленные пятна.
10. Отбеливание старого фарфора
Если ваша фарфоровая раковина на пьедестале пожелтела, вы можете сделать ее ярче, протерев влажную поверхность раковины пищевой содой, а затем протерев губкой, пропитанной 3% перекиси водорода.
11. Удаляет пену из мыла
Для еженедельной очистки душа и ванны из стекловолокна приготовьте пенящую пасту из 1 стакана пищевой соды, 1/4 стакана белого уксуса и одной или двух столовых ложек перекиси водорода. Когда пузырьки исчезнут, протрите смесью поверхность душа.
Берегитесь! Если вы используете перекись прямого действия, наденьте перчатки для защиты кожи. Перекись водорода может вызвать покраснение и жжение.
12. Удаление пятен
Рабочая группа по охране окружающей среды рекомендует перекись водорода как эффективный способ удаления пятен от травы, крови и пятен от напитков, таких как фрукты, сок и вино.Для начала попробуйте промокнуть чистящим средством изнаночную сторону ткани.
13. Осветление грязно-белого цвета
Nystul также предлагает решение, если ваши футболки, простыни и полотенца приобрели грязно-серый оттенок.
Сделайте свой собственный кислородный отбеливатель, смешав 1/2 стакана стиральной соды — совет: это не то же самое, что пищевая сода — и 1/2 стакана перекиси водорода. Запустите цикл, дайте стиральной машине наполниться и замочите одежду на пару часов, прежде чем завершить цикл для отбеливания и дезинфекции.
Подождите! Сначала возьмите образец. Прежде чем попробовать перекись водорода на какой-либо ткани, проверьте стойкость окраски на небольшом удаленном участке. Будьте особенно осторожны с винтажными тканями: эксперты Смитсоновского института по сохранению тканей говорят, что перекись может отбеливать и ослаблять волокна.
14. Проращивайте здоровые семена
Многочисленные исследования показали, что замачивание семян в 1–3-процентном растворе перекиси водорода может смягчить кожуру семян и дать начало прорастанию. Если вы хотите увеличить шансы на получение хорошего урожая, вы можете замочить семена в перекиси водорода на 20 минут перед посадкой.
15. Очистите воду пруда от водорослей
Если у вас есть водоем или пруд с карпами кои, вы можете безопасно обработать воду, чтобы уменьшить количество вредных водорослей или удалить их. Специалисты по садоводству из Get Busy Gardens использовали 1/2 стакана 3-процентной перекиси водорода, чтобы очистить пруд объемом 90 галлонов.
16. Лечите растения от грибковых инфекций.
Если ваши огородные овощи страдают от порошкообразной плесени или других грибковых инфекций, вы можете опрыскать их раствором перекиси водорода, чтобы избавить их от грибка.
Смешайте 4 чайные ложки перекиси водорода в пинте воды и опрыскайте растение. Более высокие концентрации могут сжечь нежные листья, поэтому не используйте его в полную силу.
Большинство ветеринаров больше не советуют использовать перекись водорода для очистки ран вашего питомца, независимо от того, насколько мала травма.
17. Вызвать рвоту у отравленных собак
Если ваш питомец съел что-то ядовитое, ваш ветеринар может посоветовать вам использовать перекись водорода, чтобы вызвать рвоту у животного.
Поскольку перекись водорода опасна для вашего питомца, очень важно поговорить с ветеринаром или токсикологическим центром, прежде чем пытаться вызвать рвоту этим методом.
18. Очистите туалетный лоток
Чтобы устранить запахи и продезинфицировать туалетный лоток вашей кошки, опорожните туалет, вымойте лоток горячей водой с мылом, а затем тщательно опрыскайте перекисью полной концентрации. Дайте ему постоять 15 минут, прежде чем сполоснуть, высушить и заменить подстилку.
Предупреждение о аквариуме!
Некоторые аквариумисты, увлеченные аквариумистикой, используют перекись водорода для борьбы с водорослями и очистки своих аквариумов, но прежде чем добавлять перекись водорода в ваш аквариум, посоветуйтесь с ветеринаром по рыбам. Хотя перекись водорода быстро разлагается в воде, исследования показывают, что некоторые виды декоративных рыб, в том числе гурами и сомы-присоски, не переносят этого.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) классифицирует перекись водорода как «общепризнанную безопасную» (GRAS) для людей в низких дозах.Но FDA предупреждает, что попадание перекиси водорода на кожу может вызвать раздражение, жжение и образование волдырей.
Попадание в глаза может вызвать ожог или истирание роговицы.
Вдыхание более высоких концентраций также может вызвать раздражение дыхательных путей, ощущение стеснения в груди, охриплость голоса или одышку. А проглатывание перекиси водорода, особенно в более высоких концентрациях, может вызвать рвоту, воспаление или повреждение полых органов.
Достаньте из аптечки
Перекись водорода когда-то использовалась как антисептик для поверхностных ран и травм.Сегодня для этого не рекомендуется. Хотя он действительно убивает бактерии, некоторые исследования показали, что он может быть вредным для фибробластов, которые являются клетками, которые необходимы вашему организму для заживления.
Мнения врачей неоднозначны, но теперь врачи клиники Мэйо говорят, что мы не должны использовать его для очистки порезов и ран.
Не осветляйте кожу с его помощью.
Дерматологи могут использовать перекись водорода для лечения некоторых кожных заболеваний, но это не считается безопасным способом осветления гиперпигментации в домашних условиях.Риски перевешивают любую потенциальную пользу, особенно потому, что есть другие способы осветлить темные пятна на коже.
Не используйте его для лечения прыщей
Да, он пузырится, шипит и убивает бактерии, в том числе бактерии, которые могут вызывать прыщи. Но исследование 2005 года показывает, что перекись водорода также может привести к образованию рубцов, поэтому использовать ее непосредственно при прыщах — не лучшая идея.
В общем, использовать перекись водорода на коже — не лучшая идея — даже несмотря на то, что существует множество веб-сайтов, рекламирующих ее как средство для здоровья и красоты, которое может сделать что угодно, от отбеливания ногтей до размягчения мозолей на пятках. ,
19. Обязательно используйте его для дезинфекции зубной щетки и держателя.
Американская стоматологическая ассоциация утверждает, что зубные щетки могут подвергаться воздействию фекальных колиформных и других бактерий в ванной. Небольшие количества этих бактерий обычно не вызывают проблем со здоровьем, но если вы хотите быть в безопасности, смочите зубную щетку перекисью водорода.
Исследование 2009 года показало, что полоскание перекисью водорода снижает количество бактерий на 85 процентов.
20. Используйте его для стерилизации кистей для макияжа.
Смыв излишки макияжа с кистей мягким шампунем, замочите щетину на 10 минут в миске с водой с чайной ложкой 3-процентной перекиси водорода.Вы также можете использовать его для очистки подушечек на бигуди для ресниц. Тщательно смойте остатки средства, чтобы защитить глаза.
21. Отбеливайте зубы
В наши дни яркая улыбка стоит в списке дел почти каждого, и рынок изобилует продуктами, в которых для отбеливания зубов используется перекись водорода. Концентрации различаются.
Некоторые стоматологические продукты могут содержать 10% перекиси водорода. Исследования показывают, что при правильном использовании эти продукты эффективны и безопасны.
22. Рассмотрите возможность позволить профессионалу осветлить волосы.
Перекись водорода обычно считается безопасной в коммерческих красках для волос, хотя исследования показывают, что серьезные химические ожоги могут возникнуть даже в профессиональном салоне.
Краски для волос с перекисью могут повредить ваши волосы, если вы используете их слишком часто, поэтому посоветуйтесь с опытным стилистом, чтобы составить график, который защитит ваши волосы и кожу.
Знакомая коричневая бутылка содержит 3 процента перекиси водорода, но на рынке есть гораздо более высокие концентрации, включая 35 процентов перекиси водорода пищевого качества.
В то время как перекись водорода пищевого качества широко обсуждалась как средство от таких состояний, как рак, волчанка и диабет, ее использование не подтверждается наукой или советами врачей.
Не используйте перекись водорода для лечения или попытки вылечить любое из этих состояний. Это может вызвать серьезные проблемы со здоровьем и даже привести к летальному исходу.
Перекись водорода — это бытовая химия, которую можно безопасно использовать для различных целей уборки в вашем доме. Хотя раньше его обычно использовали для дезинфекции порезов и ран, сегодня он не рекомендуется для этой цели.
Перекись водорода может снизить вероятность заболевания, если вы используете ее для дезинфекции поверхностей, продуктов и других предметов в доме.
Не используйте его на коже, не глотайте и не пробуйте перекись водорода пищевого качества в больших концентрациях, чтобы вылечить болезнь. При правильном использовании перекись водорода остается полезным домашним дезинфицирующим средством и средством для здоровья.
.
Руководство по перекиси водорода (h3O2) в гидропонике
Если вы хотите повысить урожайность сельскохозяйственных культур, химия — ваш лучший друг. Более подробное изучение биохимии растений и почвы может дать вам решающее преимущество в борьбе с вредителями и микробами.
Это вдвойне важно в гидропонике, где у вас есть полный контроль над всеми входами в вашей системе выращивания. И одно из распространенных бытовых химикатов, которое может существенно изменить вашу гидропонную систему, — это перекись водорода.
Вы, вероятно, задаетесь вопросом, какое отношение имеет сильное дезинфицирующее / отбеливающее средство к выращиванию и уходу за хрупкими растениями в зонах выращивания на водной основе. Есть две основные причины, а также пара второстепенных.
Одно достаточно очевидно, а другие не так легко приходят в голову. Прочтите, чтобы узнать, почему некоторые эксперты по гидропонике доверяют этому простому составу.
Что такое перекись водорода (h3O2)?
Перекись водорода представляет собой химическое соединение с формулой h3O2.Это простейшая форма «перекиси», которая представляет собой семейство соединений, в которых существует одинарная связь между двумя атомами кислорода.
В обычном использовании мы часто называем перекись водорода просто «перекисью». Он широко используется в промышленности из-за его способности отбеливать бумагу. В домашних условиях он содержится в моющих средствах, средствах для отбеливания волос и дезинфицирующих средствах.
Перекись была впервые обнаружена в 1818 году французским химиком Луи Тенаром. Но из-за его крайне нестабильной природы эффективное промышленное производство этого вещества будет разработано только в 20 веке.
В природе это довольно распространено и в небольших количествах также вырабатывается в организме человека. В концентрированных формах он может быть очень токсичным для людей и животных. Но на растения он оказывает уникальное воздействие, о котором мы поговорим в следующем разделе.
Значение для гидропоники
Основное значение перекиси водорода в гидропонике возникает из-за множества свойств этого соединения. К ним относятся:
Антимикробное действие

Пероксид легко образует гидроксильный радикал в кислой среде.Эти соединения губительно действуют на микробы и органические ткани.
А пероксид также выделяет одиночные молекулы кислорода в процессе естественного разложения. Эти молекулы кислорода также обладают мощным антимикробным действием.
Известно, что перекись очень эффективна против многих бактерий, вирусов и обычных вредителей. Он даже считается экологически чистым FDA.
Неустойчивость
Чистая перекись водорода — это бледно-голубая жидкость, немного гуще воды.Проще говоря, это просто вода (h3O) с дополнительной молекулой кислорода, присоединенной к ней слабой одинарной связью.
Он имеет тенденцию постепенно разлагаться на молекулы воды и кислорода, если не сопровождается стабилизирующими веществами.
Что касается молодых корней, то наличие молекул кислорода очень важно для стимулирования роста.
Во многих гидропонных системах более высокие температуры приводят к уменьшению количества молекул кислорода в воде. Этому процессу можно противодействовать, используя разложение перекиси.
Биологическая сигнализация
Перекись водорода признана сигнальным агентом во многих биологических процессах. Передача клеточных сигналов — это постоянный акт коммуникации между живыми клетками растений и животных.
Сигнальные агенты — это особые соединения, которые влияют на эти коммуникационные процессы. Они могут стимулировать клетки к определенному поведению.
Гормоны — лучший пример распространенных сигнальных агентов. Известно, что перекись оказывает определенное влияние на защитные механизмы растений, создавая каталазу у корней.
Считается, что это химическое вещество увеличивает усвоение питательных веществ корнями и оказывает другие положительные клеточные эффекты. Но исследования этих аспектов все еще продолжаются.
Действие против хлора
Было показано, что в некоторых процессах очистки сточных вод концентрированная перекись очень эффективна для удаления хлора из воды.
Теперь, если вы попробовали свои силы в гидропонике, вы уже знаете значение чистой воды. Удаление всего хлора из городской воды может быть трудным процессом.
Но следовые количества перекиси должны иметь по крайней мере некоторые положительные эффекты на любые небольшие количества хлора, все еще присутствующие в системе.
Как работает перекись в гидропонной системе
Обычно перекись водорода добавляется в небольших количествах в центральный резервуар вашей гидропонной системы. После добавления, вот как это работает простыми словами:
1. Молекулы медленно распадаются на воду и единственный атом кислорода, свободный радикал.
2. Этот свободный радикал — очень летучий агент, который может реагировать по-разному.
3. При контакте с органической клеткой, такой как бактерия или вирус, он повреждает и разрушает ее.
4. При контакте с другим атомом кислорода образуется молекула O2.
5. Эта молекула важна для здоровья корней растений.
6. Вся молекула перекиси также реагирует с любым свободным хлором в воде с образованием O2 и хлористого водорода.
Основные преимущества перекиси водорода для растений
Короче говоря, основными преимуществами использования перекиси в вашей гидропонной системе являются:
- Убивает бактерии и вирусы, отпугивает вредителей
- Помогает бороться с корневой гнилью и грибками
- Повышает содержание кислорода в воде
- Стимулирует рост корней и поглощение питательных веществ
- Удаляет хлор из воды
- Повышает общий рост и здоровье растений
Какой тип перекиси водорода лучше всего

Это очень важный вопрос, поскольку обычно используется перекись водорода доступны нам в нескольких различных формах.
Самым простым и, вероятно, самым безопасным вариантом обращения является разбавленный раствор перекиси водорода. Его легко купить в аптеках, продуктовых магазинах и супермаркетах.
Этот раствор обычно используется для местного применения и дезинфекции поверхностей и инструментов. Он доступен в растворах с концентрацией 3%, 5% и 8%.
Но это не обязательно лучшее решение по одной основной причине.
Видите ли, мы уже упоминали, что перекись водорода — очень нестабильный раствор со склонностью к разрушению.При разбавлении до 3% или 5% раствора производители должны добавлять соединения, чтобы раствор оставался стабильным.
Одним из распространенных стабилизаторов является ацетанилид, синтетическое соединение, которое в прошлом использовалось как болеутоляющее и жаропонижающее средство. Его использование было прекращено, когда стали очевидны токсические побочные эффекты.
В настоящее время влияние этих стабилизаторов на растения и их урожай малоизвестно. Они не могут иметь сколько-нибудь значительного влияния.
Фактически, на онлайн-форумах и в блогах, связанных с гидропоникой, вы часто найдете, что производители не сообщают о серьезных побочных эффектах для своих растений после использования разбавленных растворов перекиси, купленных в аптеках.
Но если вы пурист или хотите иметь полный контроль над материалами, которые попадают в вашу гидропонную систему выращивания, вам следует держаться подальше от этих разбавленных и стабилизированных растворов перекиси.
Для правильного нанесения чистой перекиси водорода всегда следует использовать перекись водорода пищевого качества.
Что такое перекись водорода пищевого качества?
Как мы уже упоминали, разбавленные растворы перекиси содержат такие добавки, как ацетанилид и фенол. Они не подходят для перорального употребления.
Если вы хотите очистить или продезинфицировать кухонные поверхности или пищевые контейнеры, вам нужна более чистая форма перекиси водорода. Пищевой перекись содержит 35% перекиси водорода, остальное — вода.
Не содержит добавок и безопасен для употребления в пищу, но ТОЛЬКО В РАЗБАВЛЕННОМ виде. Для безопасного использования вам необходимо уменьшить этот 35% раствор до 3 или 5% растворов перекиси.
Какие риски связаны с перекисью пищевого качества
Вы могли заметить, что мы упомянули разбавленную перекись как «самую простую и безопасную форму перекиси в обращении.«Это связано с тем, что чистый и концентрированный перекись является очень опасным соединением, немного похожим на кислоту.
При случайном употреблении 35% перекись может сильно сжечь и повредить пищевод и пищеварительный тракт. В тяжелых случаях это может даже привести к летальному исходу .
Случайное попадание в нос и дыхательные пути может вызвать аналогичные повреждения и травмы. Это может привести к сужению дыхательных путей и серьезным проблемам с дыханием.
Внутри тела и в кровотоке пероксид может вызывать токсические эффекты и гибель клеток.Выделение огромного количества кислорода может вызвать эмболию, буквально пузырь газообразного кислорода внутри вашего тела.
Из-за этих потенциальных опасностей при использовании перекиси водорода пищевого качества следует соблюдать следующие меры предосторожности:
- Всегда обращайтесь с этим материалом в перчатках. Избегайте контакта с кожей, уменьшив количество открытых участков кожи.
- Держите емкости с раствором перекиси четко маркированными. Случайное проглатывание обычно происходит, когда люди принимают раствор за воду.
- Храните в недоступном для детей и домашних животных. Это не требует объяснений.
Сколько перекиси водорода в гидропонике
Никогда не добавляйте концентрированный раствор перекиси водорода непосредственно в резервуар. Всегда сначала уменьшайте концентрацию, смешав одну часть 35% концентрата с одиннадцатью частями воды.
Итак, если вы возьмете одну унцию перекиси пищевого качества, смешайте ее с одиннадцатью унциями воды, чтобы получить 3% раствор. По возможности всегда используйте свежую дистиллированную воду для достижения наилучших результатов.
Рекомендуемое количество 3% раствора перекиси на галлон воды в гидропонике составляет около 3 мл на литр или 2-3 чайных ложки на галлон воды из резервуара. Обратите внимание, что речь идет о разбавленном растворе, а НЕ о 35% концентрированной перекиси.
На всякий случай, когда вы начинаете дозировку, добавляйте немного меньше, чем указано выше. В вашем местном магазине гидропоники могут быть разбавленные растворы, а также соответствующие таблицы и инструкции по смешиванию веществ.
Каждой дозы необходимо около четырех дней.При смешивании питательных растворов лучше всего добавлять перекись в одну половину, а питательные вещества — в другую, а затем смешивать их.
Заключение
Использование перекиси водорода в гидропонике дает некоторые очевидные преимущества. Но чисто концентрированный раствор сопряжен с некоторыми рисками при хранении и обращении.
Вы должны быть особенно осторожны при добавлении этого вещества в резервуар для воды. Умеренность здесь — ценная добродетель.
Но во многих случаях преимущества стоят дополнительных усилий.Разумное использование перекиси может привести к заметному улучшению роста и урожайности растений.
 .
.
статей о перекиси водорода
[Специальное примечание для читателей, читающих эту страницу из электронного перевода на ваш родной язык. Поскольку вы уже читаете эту страницу в электронном переводчике, при нажатии на любую из статей, ссылки на которые приведены ниже, статья перейдет на переведенную страницу, что позволит вам прочитать статью на своем родном языке. Кен Адачи]
[Примечание редактора: обновление , 14 марта 2013 г. .Эта индексная страница, посвященная перекиси водорода, является одной из наиболее часто читаемых страниц на этом веб-сайте месяц за месяцем. Я рад, что так много людей со всего мира могут узнать больше о чудесных способностях борьбы с микробами перекиси водорода, которую можно недорого и легко получить. Однако , с момента публикации этих статей более десяти лет назад появилось новой информации о столь же недорогой и простой в получении оксидативной терапии , которая работает лучше, чем перекись водорода и
телу легче обрабатывать.Он называется «вода CDS » и производится сначала путем объединения хлорита натрия с лимонной кислотой (называемого «MMS» или раствор M aster M ineral S ), а затем вливания полученного газа диоксида хлора в бутылка дистиллированной воды с использованием простого процесса, описанного в этой статье:
Как сделать воду CDS, самое мощное в мире средство для уничтожения микробов и болезней, в домашних условиях ~ почти ничего (15 марта 2013 г.)
http: // самообразование.орг / мм / cdsproductionexplained15mar13.shtml # сверху
Вы все еще можете читать и использовать перекись водорода, как это предлагается в статьях, размещенных здесь, но изучите основы науки о MMS в качестве основного метода оксидативной терапии на дому. книга, от рака до СПИДа, диабета, малярии и т. д. Я призываю вас прочитать это базовое руководство, объясняющее, что такое MMS и как его приготовить:
Основы науки о MMS (диоксид хлора) Sep.4, 2012
http://educate-yourself.org/mms/chlorinedioxidebasics004sep12.shtml#top
Вы можете получить ингредиенты MMS у интернет-продавцов, упомянутых в статье (или отправьте мне электронное письмо, если вам нужна дополнительная информация о том, как сделать MMS самостоятельно дома … Кен Адачи]
Кен Адачи <Редактор>
http://educate-yourself.org/hp/index.shtml#top
сентябрь 2006 г.
Переводчик Google: переводите английский на 51 другой язык
http: // translate.google.com/ пред = л # сл |? ан |
Статьи о перекиси водорода
Я решил организовать различные статьи и заметки о перекиси водорода, которые я опубликовал, в одном месте, чтобы их было легче найти. Первая статья Уолтера Гроца, почтмейстера на пенсии и сторонника перекиси водорода конца 20-го века, является таким же хорошим введением, как и любая другая, в тему перекиси водорода.
Перекись водорода — это простое химическое соединение.Это вода с присоединенным к ней дополнительным атомом кислорода h3O2. Пероксид водорода ценен как окислитель (например, озон или отбеливатель), потому что он может высвободить этот единственный атом кислорода в присутствии другого реактивного вещества . Эта реакция называется окислением , или отбеливанием.
Важно помнить, что газ, который мы называем кислородом, на самом деле состоит из ДВУХ атомов кислорода O2, тесно связанных друг с другом.
Люди и животные состоят из кислорода и углерода.Мы используем кислород (O2) для дыхания и выводим углекислый газ, CO2. Большинство микробов, вызывающих инфекции (и связанных с раковыми опухолями), не любят богатую кислородом среду. Некоторые виды бактерий (анаэробные) вообще не могут выжить при наличии кислорода, тогда как другие бактерии могут переносить его в низких концентрациях. Однако этот одиночный атом кислорода — действительно плохая новость для микробов, потому что внешней электронной оболочке атома кислорода нужно еще два электрона, чтобы чувствовать себя счастливым и «полноценным».Причина, по которой вода настолько стабильна, заключается в том, что два атома водорода (в воде) обеспечивают по одному электрону на каждый внешней орбитальной оболочки одного атома кислорода, делая его (атом кислорода) химически более стабильным.
Когда я был подростком, врач посоветовал мне использовать смесь 1/2 воды и 1/2 перекиси водорода в течение двух или трех дней, чтобы избавиться от инфекции рта.
Он сказал мне, что перекись поможет избавиться от инфекции, но , чтобы не опоздать, , просто полоскать — один раз в день — в течение двух или трех дней и все! Он заставил меня поверить, что это мощное бактерицидное средство, но что также опасен по какой-то необъяснимой причине, и что вы можете получить слишком много его, если переборщите с ! Я придерживался этого убеждения в течение многих лет, пока в середине 1990-х, когда я начал посещать выставки здоровья здесь, в южной Калифорнии, я получил новую информацию о 3.5% перекись водорода (продается в аптеке), что привело меня к осознанию того, что она не опасна, что ее можно использовать в полной концентрации ( 3% ) в качестве жидкости для полоскания рта, и что ее можно использовать довольно часто, а не экономно ( Теперь вам, медсестрам и специалистам в области здравоохранения, прежде чем вы начнете прыгать из-за того, что израсходовали запасы каталазы в организме, пожалуйста, сначала прочтите статьи и поймите, что понятие истощения каталазы было преувеличено в школьных учебниках и учебных пособиях ).
Помимо местного применения или жидкости для полоскания рта, перекись водорода можно вводить в организм в виде капель, внутривенно, инъекционно или даже вдыхать! Прочтите статьи Билла Манро ниже, чтобы узнать, как он использовал носовой распылитель, приобретенный в аптеке, для создания тонкого тумана перекиси водорода и вдохнул его. Вы поймете, почему, когда прочтете его статьи.
Было бы неплохо купить несколько книг по перекиси водорода. Мне нравится работа доктора Уильяма Кэмпбелла Дугласа
называется «Перекись водорода, Медицинское чудо » Вы можете найти
в амазонке.ком
Многие люди спрашивали меня, где взять перекись водорода для пищевых продуктов. Сегодня существует множество выходов в Интернете. Просто выполните поиск в Google по запросу «35% перекись водорода пищевого качества», и многие поставщики найдут ее.
Не пытайтесь использовать 35% перекись водорода, пока вы внимательно не изучите ее использование и свойства. . Книга доктора Уильяма К. Дугласа — хорошее руководство.
Обновление от 25 сентября 2008 г. ~ Специальное примечание для людей с поражением клеток мозга: 35% Перекись водорода является сильным ОКИСЛЯЮЩИМ агентом.При концентрации 35% и выше пероксид немедленно ОКИСЛЯЕТ кожные ткани при контакте, и поэтому вы ощущаете это как ощущение ЖОГА. НЕ допускайте контакта кожи с 35% перекисью водорода. При работе с 35% перекисью водорода используйте РЕЗИНОВЫЕ ПЕРЧАТКИ. Единственный раз, когда я беру бутылку с 35% перекисью водорода, — это когда я разбавляю ее до 3,5% перекиси и ВСЕГДА надеваю резиновые перчатки при работе с бутылкой и связанным с ней оборудованием.Это предупреждение применимо ТОЛЬКО к перекиси 35% , а НЕ перекиси аптечной марки, которая всегда составляет 3,5% (три (точки) пять процентов)
Чтобы получить 35% перекись водорода пищевого качества в Великобритании и других европейских странах, я перечислил компанию из Великобритании ниже.
Этот комплект называется пищевой перекисью водорода, h3O2 (http://www.food-grade-hydrogen-peroxide.co.uk/)
Они предлагают бесплатную доставку в пределах U.К. Я предполагаю, что они отправятся в другие страны Европы и, возможно, на другие континенты. Они предлагают ссылку на руководство по приему капель h3O2, которое вы можете прочитать здесь:
Примечания по внутреннему применению перекиси водорода пищевого качества (12 мая 2012 г.)
Протокол, на который они ссылаются, рекомендован Dr David G. Williams . Его протокол использует 35% пищевых продуктов капель h3O2, смешанных с водой, и постепенно увеличивает дозировку до 25 капель три раза в день к 16-му дню.Это составляет 75 капель 35% перекиси за один день. Это МНОГО перекиси. Чтобы играть более консервативно и посмотреть, как вы справитесь с этим, вы всегда можете следовать тому же протоколу дозировки (капли в день), рекомендованному доктором Уильямсом, но вместо этого начните с 3,5% пищевой категории (1/10 крепости). 35% для первых трехнедельных пробных версий . Затем перейдите к 17% (1/2 силы) для следующего трехнедельного испытания и, наконец, перейдите к 35% (полная сила) для третьего трехнедельного испытания.Это дает вашему телу шесть недель, чтобы постепенно увеличивать дозу до полной рекомендованной доктором Уильямсом дозы (вы также можете увеличивать силу медленнее, но и распределять ее на 15 недель, например, переходя с 1/10 от 3/10 до 5/10 до 8/10 до 10/10 концентрации на 15-й неделе (см. информацию о разбавлении ниже). Если 75 капель 35% пищевого продукта в день вызывают у вас боли в желудке, или если вы испытываете слишком сильную смерть или другой дискомфорт, ВЕРНУТЬСЯ в более низкую дозу, пока ваше тело не акклиматизируется и не сможет справиться с полной нагрузкой.Вы принимаете эти капли на голодный желудок , и НЕ ЛЕГКО обработать даже 10 или 11 капель 35% перекиси пищевого качества натощак (хотя у некоторых людей вообще нет проблем).
Доктор Уильям Кэмпбелл Дуглас более консервативен в дозировке, чем доктор Уильямс, и устанавливает верхний предел в 10 капель за сеанс 35% h3O2 в день. Есть исследования на мышах, которые показывают индукцию рака желудка при ОТНОСИТЕЛЬНО низкой концентрации h3O2. Это не значит, что исследования на мышах автоматически коррелируют с воздействием на человека, это не так, но, тем не менее, вы не должны игнорировать данные.Для любого вида легких или бронхов многие люди обнаруживают, что вдыхание тумана 3,5% пищевого качества (три целых пять десятых процента), как описано в статьях и видео Билла Манро, очень эффективно при устранении проблем с легкими и дыханием. Вы также можете добавить 3,5% перекиси пищевого качества + дистиллированную воду в комнатный испаритель.
(Этот комментарий является моим МНЕНИЕМ относительно эффективности использования пищевой перекиси водорода в качестве терапевтического средства. Это не медицинский совет или рекомендация.Принимайте собственные решения и принимайте собственные решения о том, что делать, заботясь о своем здоровье — потому что никто не заботится о вашем здоровье больше, чем вы .)
Я призываю каждого читателя изучить «Перекись водорода, медицинское чудо» доктора Уильяма Кэмпбелла Дуглас II до и приступить к пероральному приему капель перекиси водорода. Вам необходимо внимательно изучить этот предмет. и — получить информацию , прежде чем приступить к делу.
Еще один хороший источник информации о перекиси водорода — это книга Джеймса Пола Рогуски «Правда о пищевой перекиси водорода».
Как развести 35% перекись водорода до разной концентрации
1. Разбавление 35% пищевой перекиси водорода до 3,5% (крепость 1/10):
Чтобы получить 3,5%, возьмите одну часть 35% перекиси и добавьте 9 частей дистиллированной воды.
Напр. 1 унция 35% перекиси водорода + 9 унций дистиллированной воды = 10 унций 3,5% перекиси (или 2 унции 35% + 18 унций воды = 20 унций 3,5% перекиси.и т. д.)
2 . Разведение 35% пищевой перекиси водорода до 7%:
Добавьте 2 унции 35% перекиси водорода + 8 унций дистиллированной воды = 10 унций 7% перекиси.
3. Разбавление 35% пищевой перекиси водорода до 10,5%:
Добавьте 3 унции 35% перекиси + 7 унций дистиллированной воды = 10 унций 10,5% перекиси
4. Разбавление 35% пищевой перекиси водорода до 14%:
Добавьте 4 унции 35% перекиси + 6 унций дистиллированной воды = 10 унций 14% перекиси
5.Разбавление 35% пищевой перекиси водорода до 17,5%:
Добавьте 5 унций 35% перекиси + 5 унций дистиллированной воды = 10 унций 17,5% перекиси.
6. Разведение 35% пищевой перекиси водорода до 21%:
Добавьте 6 унций 35% перекиси + 4 унции дистиллированной воды = 10 унций 21% перекиси
7. Разбавление 35% пищевой перекиси водорода до 24,5%:
Добавьте 7 унций 35% перекиси + 3 унции дистиллированной воды = 10 унций 24.5% перекись
8. Разведение 35% пищевой перекиси водорода до 28%:
Добавьте 8 унций 35% перекиси + 2 унции дистиллированной воды = 10 унций 28% перекиси
9. Разведение 35% пищевой перекиси водорода до 31,5%:
Добавьте 9 унций 35% перекиси + 1 унцию дистиллированной воды = 10 унций 31,5% перекиси.
Внутривенные инфузии перекиси водорода:
(обновление , 6 января 2011 г. .В настоящее время проводится клеветническая кампания (организованная, конечно, фармацевтическими препаратами), чтобы вызвать сомнения и беспокойство по поводу использования перекиси водорода в качестве внутривенных инфузий. Некоторые врачи, которые раньше предлагали настои, теперь отказались от запугивания и угроз со стороны больших мальчиков организованной медицины. Это всегда происходит здесь, в Стране Свободы, всякий раз, когда дешевое и эффективное альтернативное лечение начинает набирать силу и становится экономической угрозой для распространителей наркотиков. Дайте мне знать, если вы найдете людей в списке 2002 года, которые больше не предлагают инфузии, или, наоборот, если вы найдете врача, который предлагает инфузии перекиси, а в списке нет ..Ken)
По ссылке ниже приведен список 2002 американских и международных врачей из Международной ассоциации оксидативной медицины (IOMA), которые предлагают
внутривенные инфузии перекиси водорода, биолюминесцентная терапия и другие терапевтические окислительные методы. ,
http://educate-yourself.org/hp/hydrogenperoxidephysICALIOMAlist2002.shtml
Статьи о перекиси водорода
(И другие оксидативные методы лечения)
Перекись водорода
Вальтер Гротц
http: // самообразование.орг / сп / hydrogenperoxidewaltergrotz20nov04.shtml
Многие преимущества перекиси водорода, доктор Дэвид Г. Уильямс
http://educate-yourself.org/cancer/benefitsofhydrogenperozide17jul03.shtml
Альтернативы в терапии рака — Перекись водорода
http://educate-yourself.org/cn/hydrogenperoxidecancertherapybookexcerpt.shtml
Перекись водорода против рака простаты
Билл Манро
(14 октября 2005 г.)
http: // самообразование.org / cn / перекись водорода и рак простаты14oct05.shtml
перекись водорода
Назальный спрей и садовые аппликации
Билл Манро
(7 февраля 2005 г.)
http://educate-yourself.org/cn/hydrogenperoxide07feb05.shtml
Терапевтическое применение гидрозона и гликозона
Чарльз Маршан
(1904)
http://educate-yourself.org/cn/hydrogenperoxidecharlesmarchand1904.shtml
Уксус и перекись водорода как дезинфицирующие средства
http: // самообразование.org / cn / Vinegarandperoxide21oct06.shtml
Письма читателей
Хроническая пневмония и вдыхание перекиси водорода (3 января 2011 г.)
http://educate-yourself.org/lte/chronicpneumoniaandperoxide03jan11.shtml
Рак легких и перекись водорода (4 ноября 2010 г.)
http://educate-yourself.org/lte/lungcancer04nov10.shtml
Коллоидное серебро и небулайзер (18 августа 2009 г.)
http://educate-yourself.org/lte/csandnebulizer18aug09.shtml
Перекись водорода и ХОБЛ (хроническая обструктивная болезнь легких)
12 июля 2009 г.
http://educate-yourself.org/lte/copdandhydrogenperoxide12jul09.shtml
Перекись водорода и IQ при комнатной температуре, смертельная смесь (25 сентября 2008 г.)
http://educate-yourself.org/lte/peroxideuse25sep08.shtml
Прием капель пищевой перекиси водорода и воды (20 сентября 2008 г.)
http://educate-yourself.org/lte/peroxidedrops19sep08.shtml
Диоксид хлора (MMS), мощный и недорогой убийца микробов
(26 июня 2008 г.)
http: // самообразование.org / cn / chlorinedioxide26jun08.shtml
получает преимущества от ежедневного приема капель перекиси водорода (23 сентября 2007 г.)
http://educate-yourself.org/lte/benefitsfromh3O2takendaily23sep07.shtml
Лечение хронической обструктивной болезни легких и эмфиземы с помощью перекиси водорода
(19 апреля 2007 г.)
http://educate-yourself.org/lte/hydrogenperoxideandpulmonarydisease14apr07.shtml
Перекись водорода справляется с желудочным заболеванием и идеи для борцов с микробами (февраль.12, 2007)
http://educate-yourself.org/lte/hydrogenperoxidehelpsJo12feb07.shtml
©
Copyright 2006-2011 Educate-Yourself.org Все права защищены.
.
